2025年6月,国际顶级期刊《Nature》新闻头条报道了一项颠覆性的研究成果:美国德克萨斯大学MD安德森癌症中心沈西凌(Xiling Shen)教授团队,创新性地将培育好的人类肠道、肝脏及大脑类器官,直接注射入怀孕小鼠的羊膜腔内。

△ Nature新闻原文
这些人类细胞成功“入住”发育中的小鼠胚胎,精准归巢至对应器官(肠、肝、脑),并在小鼠出生后长期稳定存活且发挥功能。
这一突破绕过了传统人-兽嵌合体构建的技术瓶颈,为在动物体内培育人类移植器官、模拟人类疾病及药物测试开辟了前所未有的便捷途径。

△ 美国德克萨斯大学MD安德森癌症中心沈西凌(Xiling Shen)教授
该研究不仅标志着类器官技术在活体应用上的里程碑飞跃,更引发了科学界对技术潜力与伦理边界的热烈探讨。
一、 人-兽嵌合体:宏伟目标与艰难瓶颈
人-兽嵌合体研究承载着再生医学的终极梦想之一——在动物体内培育可供移植的人类器官,以解决全球性的器官短缺危机。
其原理是通过将人类多能干细胞植入动物早期胚胎,期望人类细胞能参与胚胎发育,最终在动物体内形成特定的人类器官或组织。
1. 传统技术路径与困境
(1)低存活率:将人类多能干细胞直接注射到动物(如猪、小鼠)胚胎内,仅有极少量细胞能存活并整合(赖良学研究显示猪胚胎中人源心脏细胞短暂跳动21天)。
(2)可控性差:多能干细胞具有发育成任何细胞类型的潜力,难以精准导向形成目标器官,且存在形成人类生殖细胞等伦理风险。
(3)发育环境不兼容:跨物种细胞间的信号交流障碍,导致人类细胞在动物胚胎中难以长期存活和正常分化。
> 沈西凌教授说:“我们意识到,或许问题在于注射的细胞太‘幼稚’(指多能干细胞)。如果让它们在体外先‘长大’一点,形成更成熟、更有组织的结构(即类器官),它们可能更懂得如何在动物体内‘安家落户’并执行特定功能。”
二、 颠覆性突破:类器官羊膜腔注射技术
沈西凌团队的核心创新在于利用类器官作为“细胞递送载体”,并选择了羊膜腔注射这一相对简单、微创的途径。
1. 技术流程
(1)类器官制备:利用重编程的人类干细胞(如iPSC),在体外三维培养环境中,定向诱导分化出结构功能接近真实器官的人类肠道类器官、肝脏类器官、大脑皮层类器官。
(2)精准递送:在雌性小鼠妊娠早期(胚胎发育关键窗口期),通过微创操作将上述类器官直接注入包裹胚胎的羊水(羊膜腔)中。
(3)自然整合:注入的类器官细胞在羊水中悬浮,随后神奇地自发迁移、渗透入发育中的小鼠胚胎内部。关键在于:无需破坏胚胎壁!
(4)精准归巢与稳定共存:这些人类细胞展现出惊人的“归巢本能”——肠道类器官细胞只进入小鼠肠道、肝脏类器官细胞只进入肝脏、大脑类器官细胞只进入大脑皮层区域。它们在小鼠胚胎内增殖,并随其发育至足月出生。
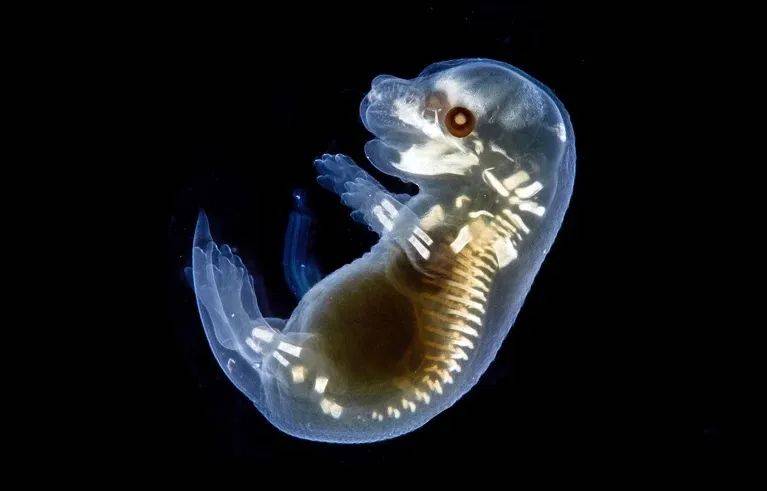
△ 含有人类细胞的小鼠胚胎光镜照片。
2. 核心优势
(1)简便高效:操作相对简单,规避了复杂且损伤大的胚胎显微注射。
(2)精准靶向:类器官细胞已具备器官特异性,大幅提高归巢至目标器官的效率和特异性。
(3)长期稳定:出生后的小鼠体内,人类细胞在目标器官中稳定存在至少2个月(实验观察期),且占比虽低但功能活跃(如人肝细胞持续分泌人血清白蛋白)。
(4)安全性提升:类器官细胞分化程度高于多能干细胞,降低了形成畸胎瘤或意外分化为生殖细胞等风险。
> 斯坦福大学干细胞生物学家Hiromitsu Nakauchi曾说:“如果仅仅通过向羊膜腔注射细胞就能实现嵌合,那将是一种极其便捷的方法,有望给该领域带来颠覆性改变。”
三、 实验结果:从概念验证到初步成功
沈西凌研究团队提供了令人信服的数据,证实了该技术的可行性和潜力。
1. 嵌合比例
约10% 的出生小鼠在其肠道内检测到人类细胞。
在含人类细胞的肠道中,人类细胞约占肠道细胞总数的1%。
肝脏和大脑中的人类细胞比例更低(未达1%),但明确存在(尤其在大脑皮层区域)。
2. 细胞功能
整合到小鼠肝脏中的人类肝细胞持续分泌人血清白蛋白,证明其生理功能正常。
3. 长期稳定性
人类细胞在小鼠出生后稳定存在至少两个月(实验结束时间点),“表现得相当稳定(沈西凌说)”。
4. 特异性
人类细胞严格归巢至其类器官来源对应的器官(肠、肝、脑),未发现明显的“错位”整合。
四、 类器官技术:从体外模型到活体整合的飞跃
此项Nature头条研究对类器官领域的影响是革命性和方向性的。
1. 验证了类器官在活体内的强大整合与功能潜力
此前类器官主要作为体外疾病模型、药物筛选平台和毒性测试工具。
该研究首次有力证明,结构化的类器官不仅能在活体动物复杂环境中存活,还能精准定位、整合到发育中的对应器官,并长期维持其特定细胞功能。这极大地拓展了类器官的应用疆界。
2. 开辟了类器官递送与应用的革命性途径
“羊膜腔注射”作为一种相对简单、微创的递送策略,为利用类器官进行宫内治疗(如先天性畸形修复) 或研究胚胎发育过程提供了前所未有的思路。其便捷性远超传统胚胎操作技术。
3. 为基于类器官的再生医学铺平道路
该技术为实现“在动物体内培育人类移植器官”的终极目标提供了更可行、更可控的新路径。
通过优化,未来有望在大型动物(如猪)体内,利用其更接近人类的器官大小和生理环境,培育出主要由人类类器官衍生细胞构成、血管化良好且免疫兼容的器官。
4. 推动类器官技术的标准化与复杂化
为了满足活体整合的需求,对类器官的纯度、成熟度、均一性、功能性及安全性提出了更高要求。这将倒逼类器官培养技术向更标准化、更复杂(如包含血管前体细胞、免疫细胞)的方向发展。
5. 深化对发育生物学基本规律的理解
人类类器官细胞在小鼠胚胎中展现的惊人“归巢”能力,提示不同物种间可能共享着保守的器官发育“地址编码”信号系统。这为研究跨物种器官发育的共性与差异提供了独特窗口。
五、 伦理考量:进步伴随的警醒
技术的飞跃必然伴随伦理思辨,此项研究尤其引发了关于大脑嵌合的深切关注。
1. “人性化”忧虑
将人类脑类器官细胞引入动物(尤其是灵长类等认知能力较高的动物)大脑,理论上存在赋予动物类人认知、情感或意识的风险。
尽管沈西凌实验中,小鼠大脑内人类细胞占比极低(远低于1%),他本人也强调:“如果将来能够引入更多的人类细胞/组织,由此带来的认知能力可能真的会成为一个值得关注的问题。”
2. 物种界限与尊严
大规模制造含高比例人类细胞(尤其神经细胞)的动物,挑战了关于物种独特性与动物伦理地位的既有认知。
3. 生殖系传递风险
虽然类器官细胞分化程度较高,但理论上仍需严格监控,防止其意外整合入生殖腺,导致人类遗传物质通过动物生殖传递给后代。
结语
沈西凌教授团队利用类器官羊膜腔注射技术,成功实现人类细胞在小鼠体内的精准整合与长期功能存活,荣登《Nature》头条,绝非偶然。
它代表了类器官技术与发育生物学、再生医学的一次完美碰撞与深度融合,其简便性、靶向性和稳定性优势,为在动物体内培育人类器官、研究发育与疾病、探索新型治疗策略打开了一扇极具潜力的大门。
这项突破性进展,无疑是类器官领域从体外模型走向活体应用的划时代里程碑。它极大地提升了类器官在解决重大医学难题(如器官移植)中的战略价值,也必然推动类器官技术本身向更高阶、更复杂的方向迭代升级。
然而,伴随着巨大机遇的是沉甸甸的责任。人类细胞,尤其是神经细胞在动物体内的整合,如同一把双刃剑,要求科学共同体、伦理学家、政策制定者和公众携手,在创新探索与伦理约束之间找到审慎而智慧的平衡点。
唯有在敬畏生命、坚守伦理的前提下,这项令人振奋的技术才能真正点亮人类健康与福祉的未来。


181-1633-5069
192-3212-4505